Etiquetas
- célula (1)
- eucarionte (1)
- maqueta (1)
- transparente (1)
carta a mis alumnos
viernes, 18 de junio de 2010
martes, 15 de junio de 2010
sábado, 12 de junio de 2010
:)ESTRUCTURA DE LEWIS
La estructura de lewis es una forma de representar los electrones de valencia de un átomo, es decir aquellos electrones que se encuentran en el último nivel energético de un átomo.
Para ello es necesario conocer el número atómico del elemento
y luego determinar la configuración electrónica.
desde allí ubicar los electrones del último nivel.
Para hacer la estructura de lewis de un átomo debes :
1º.- conocer su número atómico (Z).
2º.- hacer su configuración electrónica.
3º.- desde allí sabrás los electrones del último nivel de energía.
4º.- ubicar los electrones alrededor del símbolo del elemento de acuerdo al siguiente esquema.
¿Como es la estructura de lewis del elemento nitrógeno? (Z= 7)
1º.- del número atómico (Z), podemos deducir que el número de electrones del nitrógeno es 7. (átomo neutro) .
2º.- su configuración electrónica es : 1s2-2s2-2p3.
3º.- podemos ver que en el segundo nivel de energía existen 5 electrones(2s2-2p3).
4º.- entonces siguiendo el esquema de lewis podemos escribir .
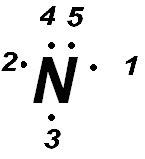 , con lo que la estructura de lewis quedará así
, con lo que la estructura de lewis quedará así
He ahí la estructura de lewis.
Prueba ahora tu solo con la estructura de (Magnesio Mg, Z= 12).
(Fluor Z= 9),
todos los átomos tienden a tener ocho electrones en su último nivel( según la llamada regla del octeto)
como puedes ver el silicio se encuentra estable debido aque en su último nivel de energía posee ocho electrones.
al igual que un gas noble.
Escribe las estructuras de Lewis de los siguientes compuestos, e indica qué átomos presentan cargas formales en los compuestos que sea necesario:

Solución 2.1
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
miércoles, 9 de junio de 2010
EL ATOMO by Robles T
- conocer el atomo y sus particulas principales.
- comprender los conceptos de nùmero atòmico y nùmero màsico.
- entender el modelo atòmico de Neils Bohr.
- comprender los conceptos relacionados con la configuraciòn electrònica.
- deducir a partir de este material la representaciòn atomica de Lewis.
tabla periòdica
miércoles, 2 de junio de 2010
:)= CINÉTICA QUIMICA
Apunte de Cinética Química:
Velocidad de reacción.
factores que modifican la velocidad de las reacciones.
Temperatura.
Concentración.
Catalizadores.
Cuando algunas sustancias reaccionan lo hacen en forma lenta, por ejemplo el hierro en presencia de aire; otras reaccionan rápidamente,como por ejemplo el sodio también en presencia de aire; y hay sustancias como el papel en presencia de aire que no reaccionarían jamas sin el auxilio del fuego, pero una vez comenzada la reacción ésta se desarrolla rápidamente.
Entonces, tanto para que una reacción ocurra, como para modificar su velocidad, se deberán tener en cuenta varios factores.
Velocidad de reacción
La cinética química busca la relación entre la forma precisa en que varía la velocidad de reacción con el tiempo, y la naturaleza de las colisiones intermoleculares (que controlan la velocidad) implicadas en la generación de los productos de reacción.
La velocidad de reacción se expresa de la siguiente forma:
Velocidad =
moles o gramos de sustancias que reaccionan por litro
(1)
tiempo en segundos
Velocidad =
moles o gramos de sustancias obtenidas por litro
(2)
tiempo en segundos
Por ejemplo:
HCl + NaOH ® NaCl + H2O
Para esta ecuación la expresión de velocidad es:
1) Moles o gramos de HCl o de NaOH por litro y por segundo.
2) Moles o gramos de NaCl o de H2O por litro y por segundo.
Los moles o gramos de sustancia por litro de solución es la concentración, expresada como molaridad o simplemente en g/l. Por lo tanto, la velocidad de reacción se puede expresar como:
V = C/t (3)
Naturaleza de los reactantes
La naturaleza de los reactantes involucrados en una reacción determina el tipo de reacción que se efectúa. Las reacciones en las cuales se redistribuyen enlaces o se transfieren electrones pueden ser más lentas que las que no involucran estos cambios. Las reacciones iónicas se efectúan inmediatamente, esto se debe a las frecuentes colisiones entre iones con cargas opuestas.
En una reacción iónica no hay transferencia de electrones. Las reacciones entre moléculas neutras pueden ser más lentas que las iónicas a causa de la transferencia electrónica y redistribución de enlaces. La mayor parte de las colisiones moleculares son elásticas, por lo tanto,las moléculas simplemente rebotan y se apartan sin cambios. Sin embargo, algunas colisiones tienen la suficiente energía para ocasionar cambios en las nubes electrónicas de las moléculas que chocan. Cuando ocurre el cambio, las moléculas que chocan pueden formar el complejo activado. La energía requerida para formar este se conoce como energía de activación. Si esta es pequeña pocas de las colisiones tienen la suficiente energía para formar el complejo activado. Por lo tanto, la reacción puede ser tan lenta que no es detectable.
Por ejemplo, el hidrógeno y el oxígeno pueden mantenerse durante años en el mismo recipiente sin reaccionar. Aunque hay colisiones entre las moléculas, no se alcanza la energía de activación. Sin embargo, si la mezcla se calienta a 800 °C, o se introduce una llama o una chispa en el recipiente, el hidrógeno y el oxígeno reaccionan violentamente. El calor, la llama o la chispa suministran la energía de activación.
Para que dos sustancia reaccionen, sus moléculas, átomos o iones deben chocar. Estos choques producen un nuevo ordenamiento electrónico y, por consiguiente un nuevo ordenamiento entre sus enlaces químicos, originando nuevas sustancias.
1. Temperatura
Según la Teoría Cinética, la temperatura aumenta la energía cinética de las moléculas o iones y por consiguiente el movimiento de estos, con lo cual, aumenta la posibilidad de choques entre las moléculas o iones de los reactivos, aumentando la posibilidad de que ocurra la reacción o acelerando una reacción en desarrollo.
Sin embargo, el incremento de la velocidad de la reacción no depende tanto del incremento del número de colisiones, cómo del número de moléculas que han alcanzado la energía de activación.
La velocidad de una reacción crece, en general, con la temperatura, y se duplica, aproximadamente, por cada 10 °C que aumenta la temperatura.
Por ejemplo, el cloruro de sodio reacciona lentamente con el ácido sulfúrico. Si se le proporciona calor aumenta la velocidad de reacción dando sulfato de sodio (Na2SO4) y ácido clorhídrico:
2.NaCl + H2SO4 ® Na2SO4 + 2.HCl
Recordemos que los combustibles para ser quemado,primero deben alcanzar su punto de combustión, luego por ser reacciones exotérmicas (liberan calor) la combustión continúa sola.
Cuando una o todas las sustancias que se combinan se hallan en estado sólido, la velocidad de reacción depende de la superficie expuesta en la reacción. Cuando los sólidos están molidos o en granos, aumenta la superficie de contacto y por consiguiente, aumenta la posibilidad de choque y la reacción es más veloz.
Lo mismo ocurre cuando las sustancias reaccionantes no son miscibles entre sí, como por ejemplo, en la hidrólisis neutra de un aceite, se hace reaccionar éste con agua,para lograrlo, el agua de la parte inferior (recordemos que el aceite es más liviano que el agua) se recircula hacia la parte superior rociándola sobre la superficie del aceite.
Otro ejemplo sería el de un kilo de viruta de madera, que se quema más rápido que un tronco de un kilo de masa.
Para comprender mejor esto realicemos el siguiente cálculo: un cubo de un metro de lado (de cualquier material), tiene una superficie de:
S cubo = 6.l.l ÞS cubo = 6.(1 m) ² ÞS cubo = 6 m ² (4)
Si a este cubo lo dividimos en 1000 cubitos de 0,10 m de lado, tendremos para un cubito una superficie de:
S cubito = 6.l.l ÞS cubito = 6.(0,10 m) ² ÞS cubito = 0,06 m ²
El total de la superficie de los 1000 cubitos es:
S cubitos = 1000. 0,06 m ² ÞS cubitos = 60 m ² (5)
Comparando los resultados (4) y (5) se observa cuantitativamente que aumento la superficie de contacto.
3. Agitación
La agitación es una variante del punto anterior, lo que se logra agitando las sustancias reaccionantes, es mezclar íntimamente los reactivo aumentando la superficie de contacto entre ellos.
4. Luz
Hay reacciones que en la oscuridad son muy lentas,como por ejemplo, la combinación del hidrógeno con el cloro. La luz solar acelera la reacción de modo tal, que a la luz solar directa, la reacción se hace explosiva:
H2 + Cl2 ® 2.HCl
Lo mismo ocurre en la formación de glúcidos por los vegetales verdes a partir del agua y el dióxido de carbono en la fotosíntesis. Ocurre lo mismo con la descomposición de sustancias poco estables, por tal motivo se envasan en recipientes que impidan el paso de la luz, como por ejemplo,el peróxido de hidrógeno:
2.H2O2 + luz ® 2.H2O + O2 (g) (rápida)
La velocidad de una reacción química es proporcional a la concentración en moles por litro (moles/litro), de las sustancias reaccionantes.
Si dos sustancias homogéneas A y B (gases o soluciones) reaccionan:
A + B ® C + D (6)
La velocidad de la reacción es:
V = [A].[B] (7)
En la que los corchetes señalan concentraciones en moles por litro. Observemos que si duplicamos la concentración, por ejemplo, de la sustancia A, la velocidad de la reacción se duplica:
V* =2.[A].[B] (8)
Si las sustancias que reaccionan son gaseosas, la concentración de las mismas aumenta disminuyendo el volumen, lo que se logra aumentando la presión.
En la figura anterior se observa, que aumentando la presión las moléculas de las sustancias reaccionantes se aproximan entre sí, acrecentando la posibilidad de choque entre sus moléculas, y por consiguiente se acelera la reacción.
Se llaman catalizadores a las sustancias que intervienen en las reacciones, acelerándolas o retardándolas y que siguen presentes al finalizar la reacción, es decir que no se consumen en esta, no son parte de los productos reaccionantes. Las sustancias que retardan la velocidad de reacción se denominan inhibidores.
Por ejemplo, añadiendo dióxido de manganeso (MnO2) al peróxido de hidrógeno (H2O2), se observa que se descompone liberando abundante oxígeno:
2.H2O2 + n.MnO2 ® 2.H2O + O2 (g) + n.MnO2 (rápida)
La cantidad n de dióxido de manganeso (MnO2) permanece constante luego de finalizada la reacción.
i. Catalizadores de contacto o heterogéneos:
No reaccionan químicamente con las sustancias del sistema: adsorben en su superficie, las moléculas de esas sustancias reaccionantes, aumentan, por consiguiente, el número de choques entre ellas y aceleran la reacción.
Una reacción en la cual los reactantes y el catalizador no están en la misma fase (estado) es una reacción heterogénea. Este tipo de catalizadores generalmente producen una superficie donde las sustancias pueden reaccionar, estos catalizadores funcionan adsorbiendo alguno de los reactantes, debilitando el enlace en cuestión hasta el punto en que el otro reactante rompe dicho enlace. La adsorción es la adherencia de una sustancia a la superficie de otra.
Algunos metales (finamente divididos para aumentar la superficie de contacto) actúan como catalizadores de contacto: platino, níquel, óxido férrico (Fe2O3), pentóxido de vanadio (V2O5), entre otros. El dióxido de azufre (SO2) reacciona lentamente con el oxígeno:
2.SO2 + O2 ® 2.SO3 (lenta)
Pero, en presencia de platino y de calor, la reacción es inmediata:
2.SO2 + O2 (amianto platinado + calor) ® 2.SO3 (rápida)
ii. Catalizadores de transporte u homogéneos:
Estos catalizadores actúan interviniendo en la reacción y luego se regeneran al finalizar la misma. Un catalizador homogéneo se encuentra en la misma fase (estado) que los reactantes
Por ejemplo, el empleo de monóxido de nitrógeno (NO) para catalizar la reacción entre el dióxido de azufre (SO2) y el oxígeno:
2.SO2 + O2 ® 2.SO3 (lenta)
El monóxido de nitrógeno (NO) reacciona con el oxígeno (oxidándose) dando dióxido de nitrógeno (NO2):
2.NO + O2 ® 2.NO2
Luego el dióxido de nitrógeno reacciona (reduciéndose) con el dióxido de azufre (este se oxida), dando trióxido de azufre (SO3) y regenerándose el monóxido de nitrógeno (NO):
2.SO2 + 2.NO2 ® 2.NO + 2.SO3
a) Gran desproporción entre la masa de las sustancias que reaccionan y la pequeña masa del catalizador.
b) El catalizador se halla igual al final del proceso, que al comienzo de él.
c) Un catalizador no produce una reacción que sin él no se realiza, solo modifica la velocidad de la misma.
d) Los catalizadores son específicos de cada reacción o de un cierto grupo de reacciones.
La absorción de las impurezas que acompañan a las sustancias reaccionantes, pueden disminuir o detener la acción del catalizador. Estas sustancias que retardan la acción de los catalizadores se denominan venenos del catalizador.











